
Садржај
Каталаза је ензим који се налази у ћелијама животиња, биљака и аеробних бактерија. Ензим је велики молекул, синтетизован у ћелијама и произведен да делује као катализатор у реакцији. Сваки тип ензима обавља специфичну функцију, а функција каталазе је да претвори потенцијално штетан нуспродукт у елементе корисне за ћелију.

Фунцтион
Каталаза, као и већина ензима, је протеин. Налази се у пероксизомима, који су мембранске ћелијске органеле. Каталаза има важну биолошку функцију: катализира разградњу водиковог пероксида, твари која је токсична за организме, у воду и молекуларни кисик, који су и безопасни и корисни.

Структура
Структура бучице каталазе садржи четири полипептидна ланца, од којих сваки садржи више од 500 аминокиселина. Каталаза такође има четири хеме групе, које су направљене од протопорфиринских прстенова, који садрже један атом гвожђа. Ови прстенови су смештени у четири ланца.
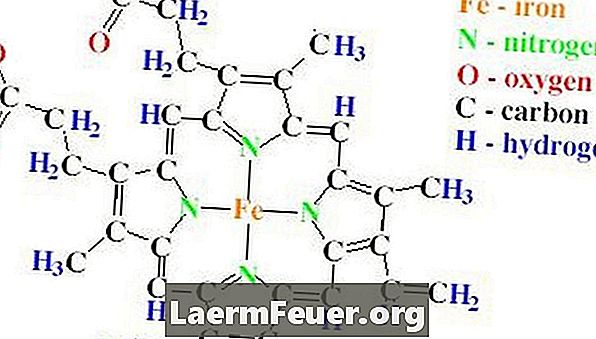
Думбелна структура каталазе садржи четири полипептидна ланца, од којих сваки садржи више од 500 аминокиселина
Значај каталазе
Водиков пероксид је нуспродукт многих биолошких функција организама. Сви аеробни организми користе кисеоник у дисању. Редукција кисеоника у води је често непотпуна, а додатни електрон из металног јона се може пренети, што доводи до стварања пероксида. Међутим, већина водоник пероксида настаје током производње АТП у митохондријима. Иако је водоник пероксид токсичан за живе ћелије, реакција да се она поново разбије у воду и кисеоник долази брзо и ефикасно. Каталаза је позната као један од најефикаснијих ензима, са прометом од око 200.000 догађаја / секунди / подјединица. Без каталазе да би се повећала брзина реакција, водиков пероксид би остао, оштећујући ћелије.
Фактори који утичу на ефикасност каталазе
Каталаза и стопа њене активности се мењају неколико фактора, укључујући температуру, пХ, концентрацију соли, количину супстрата и присуство инхибитора или активатора. Температура је важан фактор у свим биохемијским реакцијама, јер висока температура може изазвати денатурацију ензима. Када је ензим денатуриран, он мења своју конформацију, узрокујући да се супстрат веже мање ефикасно, чиме се смањује брзина реакције. С друге стране, док се не постигне максимална температура (која је различита за сваки тип каталазе), брзина реакције ће се повећати заједно са температуром. ПХ, мера киселости или концентрације јона водоника у раствору, мери се на скали од 0 до 14. Како раствор постаје киселији (испод 7), ензим може да добије водонични јон из раствора. и како раствор постаје базичнији (изнад 7), може изгубити водонични јон. Било која од ових екстрема може смањити брзину реакције, јер се хемијске везе каталазе мијењају. Постоје два типа инхибитора: неконкурентни инхибитори, који се везују за место које није активно место, и компетитивне инхибиторе, који се везују за активно место каталазе. Бакар сулфат је познати неконкурентни инхибитор каталазе, а цијанид је познат као конкурентни инхибитор. Опћенито, како се количина водиковог пероксида повећава, брзина реакције ће се такођер повећати. Међутим, ензимске реакције слиједе Мицхаелис-Ментенову једнаџбу, која каже да ће свака реакција досећи точку засићења, што значи да при максималној брзини реакције, додавање више супстрата више неће имати ефекта.
Друге употребе каталазе
Како је каталаза присутна у готово свим живим организмима, она је један од најчешће проучаваних ензима. То је навело научнике да пронађу друге функције за овај ефикасни ензим. Каталаза се користи за третирање унутрашњости пластике за паковање хране. Спречава оксидацију, те стога помаже у очувању хране. Каталаза се такође користи у процесу хладне стерилизације, што је процес конзервирања млека и сира третирањем водоник пероксидом. Овај ензим се користи за уклањање преосталих трагова водоник пероксида.