Садржај
- Упутства
- Број електрона у валентном слоју
- Левисова структура
- Формални набој сваког атома
- Обавештење
- Шта ти треба
При одређивању формалног набоја молекула као што је ЦоЦл2 (фосген гас), потребно је знати број електрона у валентном слоју сваког атома и Левисову структуру молекула.
Упутства
-
Потражите сваки атом у периодном систему елемената да одредите број електрона у валентном слоју.
-
Подсјетимо се да су два електрона у првом под-нивоу с, два су у другом под-нивоу с, шест електрона у првом под-нивоу п, и тако даље. Подсети: 1с (^ 2) 2с (^ 2) 2п (^ 6) 3с (^ 2) 3п (^ 6).
-
Удари терет. Ако је молекул ион, додајте или одузмите један или више електрона од укупног да достигнете коначни набој.
-
За ЦоЦл2 (фосген гас): Ц = 4; О = 6; Цл = 7. Молекул није јонизован и има неутралан набој. Дакле, укупан број електрона у валентном слоју је 4 + 6 + (7к2) = 24.
Број електрона у валентном слоју
-
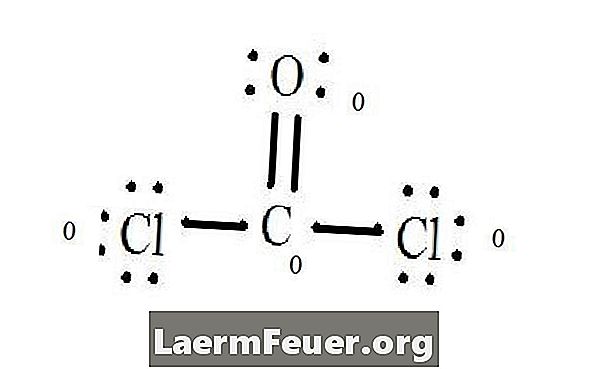
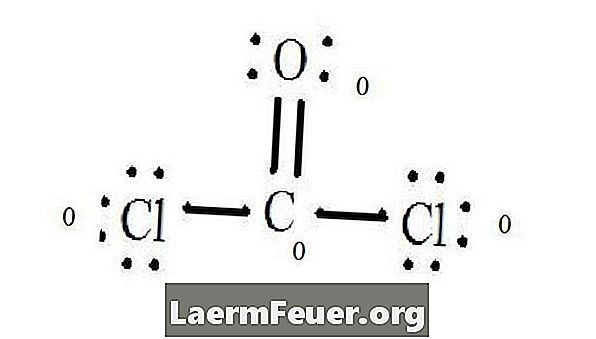
Видети Левисову дијаграм структуре ЦоЦл2 (фосген гас). Левисова структура представља најстабилнију и највјероватнију структуру за молекул. Атоми се извлаче са упареним валентним електронима; везе између слободних електрона формирају се да задовоље правило октета.
-
Нацртајте сваки атом и његове валентне електроне, а затим формирајте везе по потреби.
Електрони су нацртани на Левисовој структури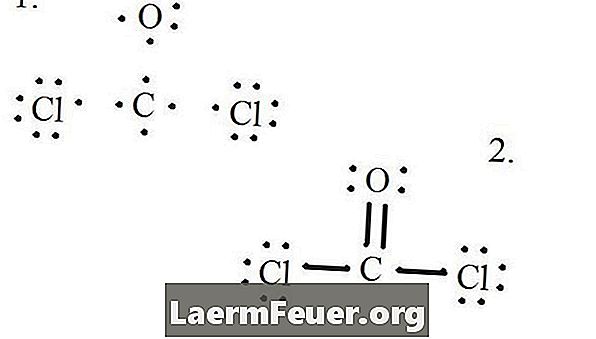
-
Атоми хлорида деле једноструке везе са молекулом угљеника, док атом кисеоника формира двоструку везу са угљеником. Сваки атом у коначној структури задовољава октетско правило и има осам електрона у валентном слоју, дозвољавајући молекуларну стабилност.
Левисова структура
-
Броји слободне електронске парове сваког атома у Левисовој структури. Сваки атом означава електрон сваке везе из које она учествује. Додајте ове бројеве. У ЦоЦл2: Ц = 0 слободних парова плус 4 везна електрона = 4 електрона. О = 4 електрона слободних парова плус 2 електрона веза = 6 електрона. Цл = 6 електрона слободних парова и један електрон једне везе са Ц = 7 електрона.
-
Одузмите количину електрона у валентном слоју на невезаном атому. Резултат је формални набој за сваки атом. У ЦоЦл2: Ц = 4 валентних електрона (ев) у невезаном атому минус 4 електрона означена у Левисовој структури (ЛС) = 0 формални набој О = 6 ев - 6 ЛС = 0 формални набој Цл = 7 и - 7 ЛС = Формална наплата
Формални набоји атома
-
Када пишете, поставите ове набоје близу атома у Левисовој структури. Ако укупан молекул има наелектрисање, ставите Левисову структуру у заграду са набојем написаном споља у горњем десном углу.
Формални набој сваког атома
Обавештење
- Израчунавање формалног набоја за молекуле који садрже прелазне метале могу бити издајнички. Број електрона у валентном слоју за прелазне метале биће они који се налазе изван узорка племенитог гаса.
Шта ти треба
- Периодни систем елемената