
Садржај
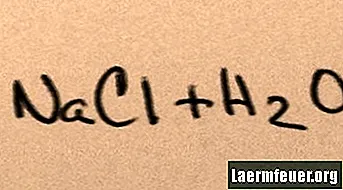
Када се сол дода води, она се раствара у својим компонентним молекулима све док максимални јони соли које вода може подржати не лебде око молекула водоника и кисеоника. Када се то догоди, решење се назива „засићено“. Када се раствори више соли, натријумови и хлоридни јони се сударају и рекомбинују у кристалима соли. Ова појава је позната под називом „падавине“, јер настала чврста супстанца пада на дно воде. Соли су „хидрофилне“, односно привлачи их вода. Ова атракција олакшава познати облик падавина: кишне капљице се формирају око ситних кристалића соли на облацима, чинећи их благо сланим.
Основна

Електролити

Сол не проводи електричну енергију у чврстом стању, али у течном (течном) стању формира решење које врло добро може провести електричну енергију. Проводљивост зависи од врсте соли која се користи, али ове течности, назване раствори електролита, су изврсни носачи једињења која су потребна људском телу. Електрични импулси које генерише мозак производе слободан кисеоник, који користи крв. Молекули соли класификују се у електролите (натријум, калијум или калцијум) и хлориде у раствору: хлорид се крв и бубрези пумпају у урин, а електролити се дистрибуирају кроз неуромишићни систем у процесу који спортисти називају рехидратација.
Колигативна својства

Било које решење се разликује од свог првобитног састава, јер додавање молекула, чак и када не формирају нова једињења, мења молекуларну тежину течности и утиче на њена својства. Слана вода је гушћа од чисте и такође се спорије леди. Како се, међутим, смрзава, мигрира до граница течности, чинећи је тежом и засићенијом, а затим снижава тачку смрзавања. На другом крају стања материје, што је слана вода гушћа, потребно јој је више топлоте да испари, док вода не истекне, остављајући слој соли. Кувари чекају да вода у лонцу прокључа да би додали сол, како не би одлагали загревање. Ове особине, познате као „колигативна својства“, помажу научницима да одреде молекуларну тежину слане воде. Ако се маса, атмосферски притисак и тачка кључања течности могу мерити, тада научници могу да одузму молекуларну тежину воде да би открили које су соли присутне.